Anna-Elina Lehtinen
kliinisen hematologian erikoislääkäri
Johdanto
Hemofiliaa ja von Willebrandin tautia vieläkin harvinaisempia hyytymistekijävajeita tunnetaan hyytymistekijän yksi (FI, fibrinogeeni), kaksi (FII, protrombiini), viisi (FV), kombinoitu hyytymistekijöiden viisi ja kahdeksan (FV+FVIII), seitsemän (FVII), kymmenen (FX), yksitoista (FXI) ja kolmetoista (FXIII) vajeet, sekä perinnöllinen K-vitamiinista riippuvien hyytymistekijöiden vaje. Näitä arvioidaan esiintyvän 1:llä henkilöllä noin 0.5-3 miljoonasta. Hemofiliat yhdessä von Willebrandin taudin kanssa edustavat suurinta osaa perinnöllisistä verenvuotosairauksista (95-97%) ja vain noin 3-5% on harvinaisia hyytymistekijävajeita. Lähi-Idässä ja eteläisessä Intiassa esiintyvyys on 10-20 kertaa suurempi johtuen sukulaisavioliitoista. Suomessa potilaita on muutamista muutamaan kymmeneen.
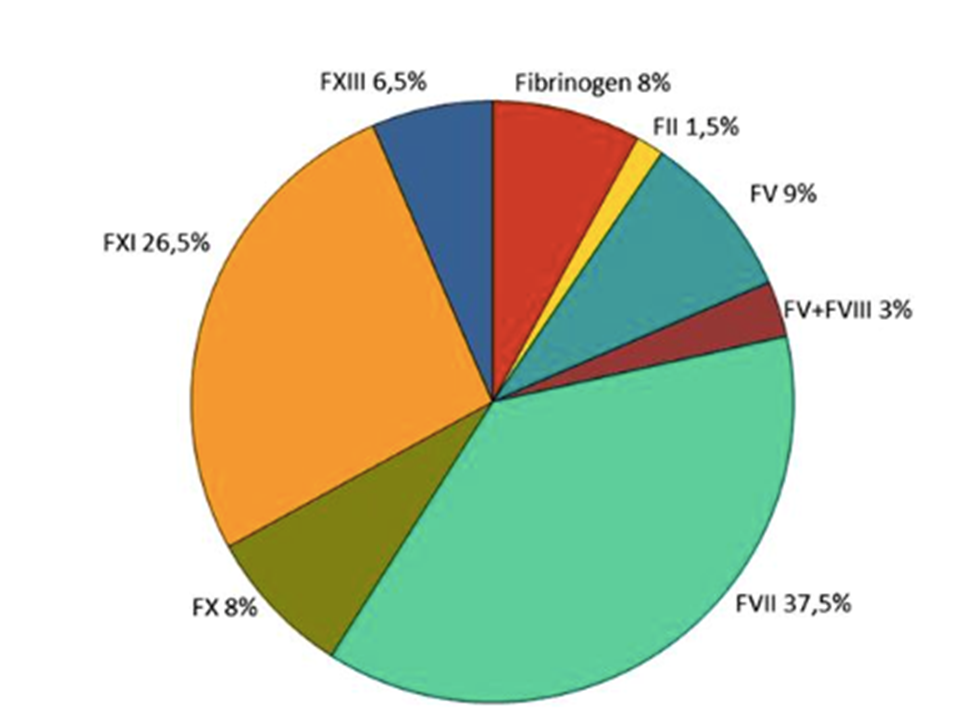
Harvinaiset hyytymistekijävajeet periytyvät ns. autosomaalisesti, toisin kuin hemofilia, jolloin niitä esiintyy sekä miehillä että naisilla. Oireiset henkilöt ovat yleensä perineet kaksi virheellistä geeniä, yhden molemmilta vanhemmiltaan (homotsygoottinen). Yhden geenin perineet henkilöt (heterotsygoottinen; vanhemmat, lapset) ovat yleensä oireettomia, kun hyytymistekijätaso on yleensä noin puolet normaalista.
Verenvuoto-oireet ovat yleisesti ottaen lievempiä kuin hemofiliassa ja ne vaihtelevat eri hyytymistekijävajeiden ja eri potilaiden välillä. Oireet eivät aina ole suoraan suhteessa hyytymistekijän tasoihin. Iho- ja limakalvovuoto-oireita ja verenvuotoja toimenpiteissä esiintyy noin 30%:lla potilaista ja gynekologisia ja synnytysvuotoja tavataan noin 20%:lla naisista. Hemofilialle tyypillisiä nivelvuotoja ja muita vakavia vuotoja esiintyy harvemmin. Vaikeita vuoto-oireita tavataan yleisimmin fibrinogeenin (FI), protrombiinin (FII) ja FX vajeissa.
Harvinaisten hyytymistekijävajeiden hoitoon ja lääkekehitykseen ei ole panostettu yhtä paljon kuin hemofiliassa ja von Willebrandin taudissa. Monissa faktorivajeissa korvaushoitona käytetään plasmaa tai sen jotakin saatavilla olevaa komponenttia yksittäisen puuttuvan tai alentuneen hyytymistekijän korvaamiseksi. Lisäksi potilaat hyötyvät traneksaamihaposta ja naiset estrogeenivalmisteista.
FI eli Fibrinogeeni
Hyytymistekijä yksi (Faktori I, FI) eli fibrinogeeni on ensimmäinen elimistön tärkeistä hyytymistapahtumaan osallistuva proteiineista. Muihin hyytymistekijöihin verrattuna sitä on verenkierrossa eniten, useita grammoja litrassa. Hyytymistapahtumassa fibrinogeenistä muodostuu trombiinin avulla fibriiniä, jonka säikeistä syntyy verihyytymä hyytymistekijän kolmetoista (FXIII) avulla. Fibrinogeeni vaikuttaa myös verihiutaleiden toimintaan. Fibrinogeenin häiriöt johtuvat joko sen puutoksesta (afibrinogenemia), vähentyneestä määrästä (hypofibrinogenemia), proteiinin toiminnan häiriöstä (dysfibrinogenemia) tai näiden yhdistelmästä (hypodysfibrinogenemia).
Fibrinogeenin vaje kuvattiin ensimmäisen kerran vuonna 1920 ja se on hyvin harvinainen, esiintyvyys on noin 1-2 tapausta miljoonasta. Useat erilaiset geenivirheet aiheuttavat fibrinogeenin häiriöitä, ne periytyvät sekä miehille että naisille. Taudinkuva on monimuotoinen.
Fibrinogeenin vaje aiheuttaa verenvuoto-oireita limakalvoilta, kuten runsaat kuukautiset, synnytysvuodot ja suolistovuodot. Myös ihonalaisia ja lihasvuotoja nähdään. Nivelvuotojakin voi esiintyä taudin vaikeimmissa muodoissa. Vuoto-oireet voivat olla lieviä tai esiintyä vain vammojen tai leikkausten yhteydessä. Dysfibrinogenemiassa tavataan joillakin verenvuoto-oireita, toisilla taas tauti ilmenee lisääntyneenä tukostaipumuksena ja joillakin voi esiintyä sekä vuoto- että tukosoireita. Jopa puolella dysfibrinogenemia on oireeton.
Fibrinogeenin häiriöt diagnosoidaan oireiden ja laboratoriolöydösten avulla. Samantyyppisiä oireita on usein suvussa. Hyytymisen seulontatutkimuksista trombiiniaika (P-Trombai) on pidentynyt. Jatkotutkimuksina mitataan fibrinogeenin aktiivisuus ja pitoisuus. Erikoislaboratoriossa voidaan tehdä geenimäärityksiä, joiden avulla selviää minkä tyyppinen vika proteiiniin on syntynyt.
Hoito vaikeassa ja keskivaikeassa fibrinogeenin vajeessa on fibrinogeenin korvaushoitoa. Fibrinogeenin puutoksessa säännöllisenä korvaushoitona plasmaperäistä valmistetta annostellaan suonensisäisesti kerran viikossa. Lievemmissä tautimuodoissa fibrinogeenia korvataan verenvuodoissa, synnytysten ja leikkausten yhteydessä. Tavoite on tällöin nostaa fibrinogeenin taso yli 1 g/l. Dysfibrinogenemiassa fibrinogeenin korvaushoidon tarve arvioidaan potilaskohtaisesti tukoksille tai vuodoille altistavissa tilanteissa, kuten leikkaukset. Tukostapahtumien hoitona ja pitkäaikaisena ennaltaehkäisynä käytetään verenohennuslääkkeitä, ns. antikoagulantteja.
FII eli Protrombiini
FII on yksi maksan K-vitamiinista riippuvista hyytymistekijöistä. Protrombiinista muodostuu trombiinia, jota tarvitaan fibrinogeenin ja useiden muiden hyytymistekijöiden aktivoimiseen ja lopulta verenvuodon tyrehdyttävän hyytymän muodostumiseen.
FII vaje on hyvin harvinainen (yhdellä kahdesta miljoonasta) ja se voi johtua joko proteiinin vähäisestä määrästä (hypoprotrombinemia) tai sen toiminnan häiriöstä (dysprotrombinemia). Periytymistapa on ns. peittyvä, jolloin tarvitaan molemmilta vanhemmilta perittyjen poikkeavien geenien yhdistelmä. Alle 20-30% FII tasot aiheuttavat verenvuoto-oireita. Amerikkalainen tohtori Armand Quick teki ensimmäiset havainnot tästä hyytymishäiriöstä vuonna 1947.
Diagnoosia voi epäillä verenvuoto-oireisella potilaalla, jos hyytymisen seulontakokeista protrombiiniaika (P-PT /TT%) on pidentynyt (Quick’n testi). Jatkotutkimuksena hyytymislaboratorio määrittää tarkemmin K-vitamiinista riippuvien faktorin aktiivisuudet. Tavallisemmat FII vajeen hankinnaiset syyt, kuten K-vitamiinin vaje tai maksasairaus, saadaan poissuljettua.
Verenvuoto-oireet voivat olla vaihtelevia. Tyypillisiä oireita ovat iho- ja limakalvovuodot, kuten herkistynyt mustelmataipumus, nenäverenvuodot, runsaat kuukautiset, mutta myös lihas- ja nivelvuotoja voi esiintyä. Vuotojen vaikeusaste korreloi hyytymistekijän tasoon.
Hoidon tavoitteena on ylläpitää FII-taso vähintään yli 20-40% tilanteesta riippuen, vaikeissa vuodoissa ja traumoissa taso korjataan normaaliksi. Erillistä FII korvaushoitovalmistetta ei ole kehitetty, mutta FII voidaan korvata käyttämällä jääplasmaa tai ns. protrombiinikompleksi konsentraattia (PCC). Lisäksi, kuten usein muissakin vuotosairauksissa, käytetään traneksaamihappoa, joka lujittaa syntyvän verihyytymän.
FV
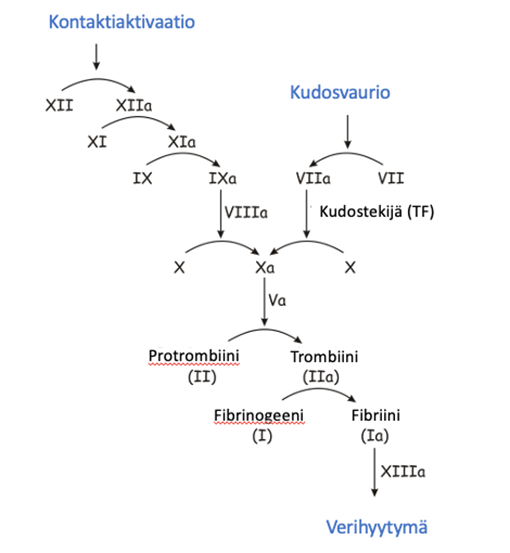
Hyytymistekijällä viisi (Faktori V, FV) on entsyymi, jolla on tärkeä rooli trombiinin muodostuksessa, keskeisessä veren hyytymisen vaiheessa. FV aktiivisessa muodossaan yhdessä aktivoidun hyytymistekijä kymmenen (FXa) ja kalsiumin kanssa saa aikaan reaktion, jossa protrombiinista (FII) muodostuu trombiinia (FIIa). FV syntyy maksasoluissa ja sitä löytyy myös verihiutaleista.
FV vajetta on kutsuttu myös Owrenin taudiksi tai parahemofiliaksi. FV mainittiin ensimmäisen kerran vuonna 1943, kun tohtori Paul Owren kuvasi ensimmäisenä FV vajetta sairastavan potilaan. Vaikea FV vajetta esiintyy vain noin yhdellä miljoonasta. Kuten monissa harvinaisissa verenvuototaudeissa, FV-vajeen syntyyn tarvitaan virheellinen geeni molemmilta vanhemmilta, eli se periytyy peittyvästi. Alle 1-10% FV tasot johtavat verenvuoto-oireisiin jo nuorena. Hyytymisen kannalta riittävä taso on 15-20% normaalista. FV on pitkävaikutteinen, sen vaikutuksen puoliintumiseen menee noin 36 tunnissa.
Diagnoosiin sopii pidentynyt hyytymisaika, P-APTT, protrombiiniajan (P-TT%) ollessa normaali, paitsi jos se mitataan ns. Owrenin menetelmällä, jota käytetään Pohjoismaiden ulkopuolella. Jatkotutkimuksena hyytymislaboratorio määrittää tarkemmin yksittäisten faktorien aktiivisuudet. Joissakin tapauksissa myös FVIII voi olla matala, kyseessä on tällöin FV ja FVIII vajeiden yhdistelmä. Perinnöllisen vajeen lisäksi FV voi olla matala myös maksasairauksissa ja joissakin immunologisissa taudeissa. Eräs FV:n geenivirhe (FV Leiden) on taas melko yleinen verisuonitukosten aiheuttaja.
FV-vajeessa oireet voivat olla hyvin vaihtelevia. Vaikeassa vajeessa (FV:n taso alle 1%) on vakavien vuotojen, kuten kallonsisäisten ja nivelvuotojen vaara. Nivelvuodot eivät kuitenkaan ole yhtä tyypillisiä kuin vaikeassa hemofiliassa. Vuoto-oireina tavataan lisäksi mustelmataipumusta, nenäverenvuotoja, suun limakalvojen vuotoja ja naisilla runsaita kuukautisia. Yli 20% FV taso riittää suojaamaan vuodoilta.
FV-konsentraatin puuttuessa verenvuotojen hoitona ja ennaltaehkäisynä voidaan hyytymistekijää korvata antamalla plasmaa (esim. Octaplas). Myös verihiutaleiden siirto edistää hyytymistä, koska verihiutaleet sisältävät FV. Traneksaamihaposta on apua etenkin limakalvovuodoissa.
FVII
Faktori VII on yksi maksan tuottamista K-vitamiinista riippuvista hyytymistekijöistä. Se aktivoituu kudosvauriossa (FVIIa) ja aloittaa veren hyytymisreaktion yhdessä kudostekijän kanssa. Hyytymistekijän seitsemän (FVII) vaje on yleisin harvinaisista hyytymistekijävajeista. Sitä esiintyy väestössä noin 1:llä 300 000-500 000:sta. Sitä tavataan etenkin Lähi-Idän alueella. Löytäjänsä mukaan FVII vajetta kutsutaan joskus Alexanderin taudiksi. Alexander kollegojensa kanssa kuvasi ensimmäisen potilaan vuonna 1951. FVII vajeen taustalla on joko proteiinin toimintavika tai sen määrällinen vähyys.
Oirekuva voi olla hyvin vaihteleva, eikä aina korreloi hyytymistekijän tasoon, lähes oireettomalla henkilöllä voi olla hyvinkin matala FVII taso. Vuoto-oireita ei yleensä esiinny FVII ollessa yli 15-20%. Vaikeassa FVII vajeessa oirekuva muistuttaa vaikeaa hemofiliaa. FVII:n vaikutusaika verenkierrossa on lyhyt, puoliintumisaika on noin 4-6 tuntia.
Tyypillinen diagnostinen laboratoriolöydös on poikkeava protrombiiniaika (alentunut P-TT%), muiden hyytymisaikamittareiden ollessa normaalit. Jatkotutkimuksena tehdään eri hyytymistekijämääritykset, joissa paljastuu matala FVII. Muita syitä FVII vajeelle voivat olla maksan vajaatoiminta ja K-vitamiinin vaje tai verenohennuslääkitys.
Tavallisimpia vuotoja ovat ien- ja nenäverenvuodot, mustelmataipumus, runsaat kuukautiset, suolistovuodot ja virtsateiden vuodot. FVII vaje voi tulla esiin kun aletaan tukia leikkaustoimenpiteen jälkivuodon syitä. Vaikeassa FVII vajeessa (taso <1%) oireina voi olla verenvuotoja niveliin, kallonsisäisesti, suolistosta ja lihaksiin.
Hoito on puuttuvan tekijän korvausta rekombinantti FVIIa valmisteella, jota vaikeassa tautimuodossa annostellaan ennalta ehkäisevästi. Lievissä tautimuodoissa korvaushoitona riittää usein plasma (esim. Octaplasâ). Lisäksi käytetään traneksaamihappoa.
FX (Stuart-Prower’in tekijä)
Hyytymistekijällä kymmenen (Faktori X, FX) on yksi K-vitamiinista riippuva plasman proteiini, jota maksa valmistaa. FX aktivoituu sekä ns. kudosvaurion (kudostekijä ja FVII) että kontaktiaktivaatioreitin (FIXa ja FVIIIa) kautta. Aktivoitu FX (FXa) yhdessä hyytymistekijän viisi (FV) ja kalsium-ionien kanssa muodostaa solupinnoille niin sanotun protrombinaasikompleksin, joka edelleen aktivoi hyytymistekijän II eli protrombiinin, trombiiniksi. Trombiini aktivoi fibrinogeenistä fibriiniä, jonka säikeistä verihyytymä muodostuu.
FX on elintärkeä proteiini, sen täydellinen puuttuminen estää sikiönkehityksen. 1950-luvulla harvinainen FX-vaje löytyi kahdelta potilaalta, nimeltään Stuart ja Prower, joiden mukaan verenvuotohäiriötä myös kutsutaan. FX geeni sijaitsee kromosomissa numero 13 ja se periytyy ns. autosomissa peittyvästi, joten sitä esiintyy sekä miehillä että naisilla, kun geenivirhe on peritty molemmilta vanhemmilta, jotka vain toisen geenivirheen kantajina ovat puolestaan oireettomia. FX-vaje on harvinainen, sitä esiintyy noin yhdellä miljoonasta.
Oireet vaihtelevat, mutta korreloivat FX-tasoon; mitä matalampi taso, sitä enemmän verenvuoto-oireita. Alle 15-20% FX taso aiheuttaa oireita. FX vaikutusaika plasmassa on pitkä, se puoliintuu noin 40-60 tunnissa.
Laboratoriokokeissa hyytymisajat, sekä APTT että TT% ovat poikkeavia. Diagnoosin varmistaa FX-määritys. FX voi olla alentunut myös hankinnaisissa tiloissa, kuten maksasairauksissa, joissakin infektioissa, amyloidoosissa ja joissakin pahanlaatuisissa taudeissa kuten leukemiassa.
Oireet vaihtelevat yksilöllisesti. Tyypillisiä oireita ovat nenäverenvuodot, runsaat kuukautisvuodot, synnytysvuodot ja verenvuodot leikkausten ja toimenpiteiden yhteydessä. Vaikeassa FX-vajeessa (FX alle 1%) voi lisäksi esiintyä nivel- ja lihasvuotoja, sekä kallonsisäisiä vuotoja.
Hoito on puuttuvan hyytymistekijän korvaushoitoa, joka voidaan toteuttaa antamalla kaikkia veren hyytymistekijöitä sisältävää plasmaa, esim. Octaplasâ tai vaikeiden vuotojen hoidossa ns. protrombiinikompleksikonsentraatti- eli PCC-valmistetta (Octaplexâ, Cofactâ), joka sisältää K-vitamiinista riippuvia hyytymistekijöitä FII, FVII, FIX ja FX. Vaikeassa FX vajeessa, johon liittyy toistuvia verenvuoto-oireita, Octaplasâ-korvaushoitoa annetaan säännöllisesti ennaltaehkäisevänä profylaksina 1-2 kertaa viikossa. Vuotojen hoidossa annos toistetaan 12 tunnin välein tarpeen mukaan. Erillistä pelkästään FX sisältävää valmistetta ei ole kehitetty.
FXI (C-hemofilia)
Faktori XI aktivoituu plasmassa hyytymistekijän XII ja trombiinin vaikutuksesta. Aktivoitu FXI pystyy edelleen aktivoimaan hyytymistekijän yhdeksän (FIX) ja sitä seuraavan reaktiosarjan lopputuloksena syntyy fibriinihyytymä. FXI vaikutusaika plasmassa on pitkä, se puoliintuu noin 40-70 tunnissa.
C-hemofilian oirekuva on vaihteleva ja verenvuoto-oireet voivat olla lieviä, vaikka FXI-taso olisi hyvinkin matala. Siten vaikea C-hemofilia eroaa merkittävästi vaikeasta A- ja B-hemofiliasta, itsestään alkavat vuodot ja nivelvuodot ovat harvinaisia, ja joskus vuoto-oireita ei esiinny juuri lainkaan. Alle 15-20% FXI-tasolla verenvuoto-oireet ovat todennäköisiä, jolloin tausalla on yleensä geenivirheen periytyminen molemmilta vanhemmilta.
FXI-vaje kuvattiin ensimmäistä kertaa vuonna 1953 Rosenthalin työryhmän toimesta potilailla, joilla havaittiin verenvuoto-oireita hampaanpoistojen yhteydessä. FXI:n geeni sijaitsee kromosomissa numero 4 ja vallitsevan periytymistavan johdosta sitä tavataan sekä miehillä että naisilla yhtä paljon. FXI-vajetta esiintyy kaikkialla maailmassa noin yhdellä miljoonasta, mutta erityisen yleinen se on Askenazi- ja Irakilais-juutalaisväestössä Lähi-Idässä, jopa 4-8%:lla.
Laboratoriokokeissa APTT on pidentynyt muiden hyytymisaikojen ollessa normaalit. Kun A- tai B-hemofilia on poissuljettu, on todennäköinen diagnoosi C-hemofilia, joka selviää mittaamalla FXI-taso. FXI voi olla hankinnaisena ilmiönä alentunut harvinaisissa Gaucherin taudissa tai Noonanin syndroomassa.
C-hemofiliassa vuoto-oireet ovat yleensä vähäisiä ja tulevatkin esiin traumojen yhteydessä tai kun tehdään jokin kajoava toimenpide tai leikkaus. Suvussa vuoto-oireet ovat usein saman tyyppisiä. Vuodot esiintyvät useimmiten iholla ja limakalvoilla, kuten nenän, suun tai virtsateiden alueella. Naisilla voi olla runsaat kuukautiset ja poikkeavia vuotoja synnytysten yhteydessä.
Hoito
Hoito on puuttuvan hyytymistekijän korvaushoitoa, joka voidaan toteuttaa antamalla kaikkia veren hyytymistekijöitä sisältävää plasmaa, esim. Octaplasâ. Vuotojen hoidossa tavoitteena on pitää FXI-taso yli 20%, vaikeissa vuodoissa normaalina, vähintään yli 50%. Tällöin annostelua toteutetaan yleensä kahdesti vuorokaudessa. Säännöllistä profylaksia tarvitaan harvoin. Erillistä pelkästään FXI sisältävää valmistetta ei toistaiseksi ole kehitetty. Kuten muissakin harvinaisissa verenvuototaudeissa, hoito ja seuranta keskitetään hyytymishäiriöihin perehtyneisiin hoitokeskuksiin.
FXII (Hageman’in tekijä)
Hyytymistekijä kaksitoista (Faktori XII, FXII) on yksi ns. kontaktitekijöistä, jota valmistetaan maksassa. Se on pitkävaikutteinen, puoliintumisaika 50-70 tuntia. Aktivoitu FII on entsyymi joka osallistuu FXI aktivointiin. Lisäksi se saa aikaan prekallikreiinista kallikreiinia. FXII vaje ei kuitenkaan aiheuta verenvuototaipumusta. Se löytyy tyypillisesti sattumalta, kun laboratoriokokeita on otettu esim. ennen jotakin suunniteltua leikkaustoimenpidettä. Tällöin APTT on merkittävästi pidentynyt oireettomalla henkilöllä, kuten John Hageman, jolla FXII-vaje ensimmäisen kerran kuvattiin vuonna 1954. FXII geeni sijaitsee kromosomissa 5. Taustalla voi olla useita erilaisia geenivirheitä ja vaje periytyy autosomissa peittyvästi. Vaikeassa FXII-vajeessa viallinen geeni on periytynyt molemmilta vanhemmilta. FXII vajeen yleisyydestä on vain vähän tietoa. Verenluovuttajilla sitä on havaittu noin 2:lla sadasta.
FXIII
Hyytymistekijän kolmetoista (faktori XIII, FXIII) tehtävä on kiinnittää fibriinisäikeet toisiinsa ja näin lujittaa syntyvän verihyytymän. FXIII kiertää veressä neliosaisena yhdisteenä, tetrameerinä, joka koostuu kahdesta alayksiköstä A ja B. Kuten suurin osa hyytymistekijöistä, FXIII B-osa valmistetaan maksassa, mutta FXIII:n A-osan tuottavat veren valkosolut, monosyytit, sekä verihiutaleiden esiasteet eli mekakaryosyytit.
FXIII (fibriiniä stabiloiva faktori) löydettiin vuonna 1948 ja tohtori Duckert kuvasi ensimmäisen potilastapauksen vuonna 1960. Kyseessä oli nuori sveitsiläinen poika, jolla haavat paranivat huonosti, mutta hyytymiskokeet olivat normaalit. Plasman antaminen korjasi hyytymishäiriötä. Neljäkymmentäviisi vuotta myöhemmin tämä sama poika osallistui tutkimuksiin, joissa selvitettiin FXIII rakenne. A- ja B-alayksiköt sijaitsevat eri kromosomeissa ja useita eri geenivirheitä on kuvattu FXIII-vajeen taustalla. Tyypin 1 geenivirheet B-alaosassa ja tyypin 2 A-alaosassa. Suurimmalla osalla FXIII-vajepotilaita on tyypin 2 A-alaosan geenivirhe. Sitä esiintyy sekä miehillä että naisilla. Periytymismekanismi on ns. peittyvä, tauti syntyy, kun virheellinen geeni on peritty molemmilta vanhemmilta. FXIII-vaje on erittäin harvinainen, sitä on arvioitu esiintyvän vain yhdellä 3-5 miljoonasta henkilöstä. Suomessa FXIII-vajepotilaita on alle 20. Vain noin 2-5% faktori taso on riittävä ja oireita esiintyy vasta kun FXIII-taso on merkittävän matala, <1%. FXIII vaikuttaa verenkierrossa pitkään, sen puoliintumisaika on arviolta 11-14 vuorokautta.
Napaverenvuoto vastasyntyneellä, hidas haavojen paraneminen tai spontaani aivoverenvuoto voivat herättää epäily FXIII vajeesta, silloin kun tavalliset hyytymisen mittarit, APTT, TT% ja trombiiniaika ovat normaalit. Matala FXIII-taso vahvistaa diagnoosin.
Vastasyntyneen napaverenvuoto on yleistä noin 80%lla tapauksissa. Tavallisia vuoto-oireita ovat limakalvovuodot, mustelmat, vuoto leikkausten yhteydessä ja toistuvat keskenmenot. Vakavin seuraus on äkillinen aivoverenvuoto, jota esiintyy jopa 30%:lla potilaista.
FXIII-vajeen hoito on puuttuvan hyytymistekijän korvaushoitoa. Plasmaperäistä konsentraattia, joka sisältää sekä A- että B-alaosat, annostellaan säännöllisesti 3-4 viikon välein suonensisäisesti. Hoitoon on kehitetty myös rekombinantti FXIII valmiste (vain A-alaosa), mutta erittäin kalliin hintansa vuoksi sitä ei ole saatavilla Suomessa.
Kirjallisuutta:
European Network of the Rare Bleeding Disorders (EN-RBD)
Mannucci PM, et al. Recessively inherited coagulation disorders. Blood 2004; 104: 1243-1252.
National Hemophilia Foundation
Palla R, et al. Rare bleeding disorders: diagnosis and treatment. Blood (2015) 125 (13): 2052–2061.
World Federation of Haemophilia (WFH)
